Aminosäure- und Glucosinolatstoffwechsel in Pflanzen
Pflanzen besitzen ein breites Spektrum an komplexen sekundären Inhaltsstoffen, um sich gegen Fraßfeinde zu wehren oder um nützliche Tiere anzulocken. Substanzen der Stoffklasse der Glucosinolate, früher Senfölglykoside genannt, kommen vorwiegend in der Familie der Kreuzblütlergewächse vor, zu denen u.a. die Kohlgewächse gehören. Glucosinolate tragen dort zum typischen Kohl-Aroma bei. Bei Verletzung der Pflanzen werden die Glucosinolate durch so genannte Myrosinasen hydrolysiert. Erst das Zusammenspiel von Glucosinolaten mit den Myrosinasen lässt die eigentlich biologisch aktiven Substanzen, meist Isothiocyanate oder Nitrile entstehen. Diese Stoffe dienen der Abwehr, sind aber auch für den Menschen von großer Bedeutung, da sie vor der Entstehung bestimmter Krebsarten schützen sollen.
Biosynthese von Glucosinolaten
Glucosinolate leiten sich von verschiedenen Aminosäuren ab. Entsprechend werden sie in verschiedene Gruppen eingeteilt. Im Folgenden werden ausschließlich die aliphatischen Glucosinolate betrachtet, deren wichtigste Vertreter ausgehend vom Methionin synthetisiert werden. Eingeleitet wird die Synthese dieser Glucosinolate durch eine Transaminierungsreaktion, bei der Methionin in die Ketosäure 4-Methylthio-2-Oxobutanoat (4MTOB) überführt wird. Die Reaktion stellt die Schnittstelle zwischen dem primären Aminosäuremetabolismus und der sekundären Glucosinolatbiosynthese dar (Abb. 1). Die weitere Synthese der Glucosinolate erfolgt in drei Phasen. Im ersten Abschnitt, dem Kettenverlängerungszyklus, wird zunächst 4MTOB um eine Methylengruppe verlängert. Die verlängerte Ketosäure 5-Methylthio-2-Oxopentanoat (5MTOP) kann durch eine erneute Transaminierungsreaktion wieder in das entsprechende Methionin-Derivat (Homo-Methionin) überführt werden, wodurch sie den Kettenverlängerungszyklus verlässt oder erneut ein- oder mehrfach den Kettenverlängerungszyklus durchläuft. Abhängig von der Anzahl der durchlaufenen Zyklen entstehen Methionin-Derivate mit unterschiedlich vielen C-Atomen. Diese sind nun Ausgangssubstrate für die zweite Phase der Synthese, der Bildung der Glucosinolatgrundgerüste, die im dritten Syntheseabschnitt verschiedene Modifikationen erfahren. So entsteht ein breites Spektrum an verschiedenen aliphatischen Glucosinolaten, die in den Vertretern der Kreuzblütler in unterschiedlicher Zusammensetzung und Menge vorliegen.

BCAT4 ist an der Schnittstelle zwischen primärem und sekundärem Stoffwechsel aktiv
Die Aufklärung der Synthesewege der aliphatischen Glucosinolate hat in den letzten Jahren starke Aufmerksamkeit erfahren. So wurden die meisten Enzyme des zweiten und dritten Syntheseweges identifiziert und beschrieben. Dagegen waren bis vor kurzem die Enzyme des ersten Syntheseabschnitts weitestgehend unbekannt. Dies galt auch für den initialen Transaminierungsschritt am Übergang vom Aminosäure- zum Glucosinolatstoffwechsel. Arabidopsis thaliana, einer der wichtigsten Modellorganismen in der Pflanzenmolekularbiologie, gehört ebenfalls zur Familie der Kreuzblütlergewächse. In dieser Pflanzenspezies wird der initiale Transaminierungsschritt von einer Branched-Chain Aminotransferase (BCAT) katalysiert. Diese Enzyme sind in einer kleinen Familie von sechs Genen kodiert. Normalerweise sind sie an der Synthese der verzweigtkettigen Aminosäuren Valin, Leucin und Isoleucin beteiligt. Eines dieser Proteine, BCAT4, zeigt jedoch ein stark verändertes Substratspektrum und setzt Methionin sehr viel effizienter um als die ursprünglichen Substrate. Schaltet man das Gen für BCAT4 aus, werden in den Pflanzen 50% weniger aliphatische Glucosinolate angehäuft. Im Gegenzug akkumulieren hauptsächlich in Samen dieser Pflanzen sehr viel mehr Methionin und dessen Speicher- und Transportform S-Methylmethionin, auch Vitamin U genannt.
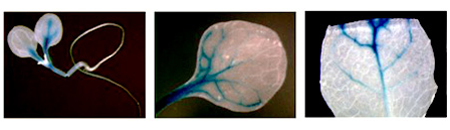
Das BCAT4-Gen ist in den Gefäßen der Pflanzen angeschaltet
Weitere Untersuchungen des BCAT4-Gens ergaben, dass dieses insbesondere nach Verletzung der Pflanze in den Gefäßen angeschaltet wird (Abb. 2). Dort wird das BCAT4 Protein ausschließlich in Phloemzellen exprimiert, in denen es sich im Cytosol anhäuft. Die nachfolgenden Reaktionen des Kettenverlängerungszyklus erfolgen jedoch in den Chloroplasten.
Die fundamentale Rolle von BCAT4 am Anfang der Synthese aliphatischer Glucosinolate deutet darauf hin, dass weitere Transaminierungsreaktionen des Kettenverlängerungszyklus ebenfalls durch BCATs katalysiert werden. Die Befunde bisheriger Untersuchungen zeigen, dass der Stoffwechsel von Methionin, Valin, Leucin und Isoleucin und die Synthese aliphatischer Glucosinolate stärker miteinander verzahnt sind als bislang angenommen.

Kontakt
- Prof. Dr. Stefan Binder
Institut Molekulare Botanik - Universität Ulm
D-89069 Ulm, Germany
Telefon: +49 (0)731/50-22625
Telefax: +49 (0)731/50-22626
