Die spezifische Leitfähigkeit ist von der Konzentration des
Elektrolyten abhängig,
die molare Leitfähigkeit ist über die elektrischen Beweglichkeiten
![]() und
und
![]() ebenfalls konzentrationsabhängig. Wenn diese Abhängigkeiten tatsächlich aufgrund der
Coulomb'schen Wechselwirkungen
der Ionen zustande kommen, so sollten sie bei sehr
starker Verdünnung (
ebenfalls konzentrationsabhängig. Wenn diese Abhängigkeiten tatsächlich aufgrund der
Coulomb'schen Wechselwirkungen
der Ionen zustande kommen, so sollten sie bei sehr
starker Verdünnung (![]() )
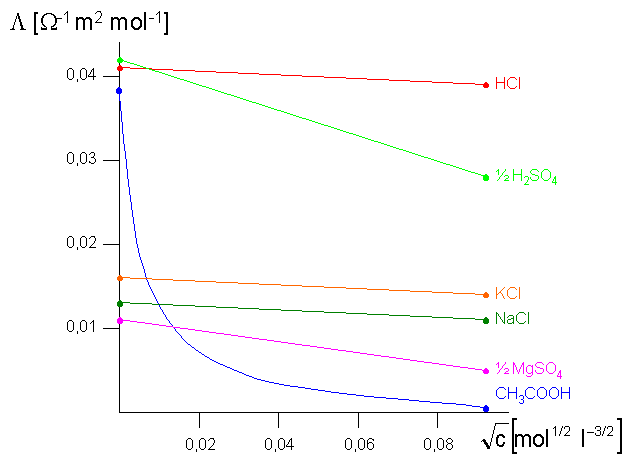
keine Rolle mehr spielen. Durch
Extrapolation der Geraden in folgender Abbildung auf
)
keine Rolle mehr spielen. Durch
Extrapolation der Geraden in folgender Abbildung auf
![]() erhält man molare
Leitfähigkeiten, die Stoffkonstanten sein sollten.
erhält man molare
Leitfähigkeiten, die Stoffkonstanten sein sollten.
 |
|
|
Abbildung 16:
Molare Grenzleitfähigkeit nach dem Kohlrauschen Quadratwurzelgesetz bei 298 K (25°C). |
Wie in dieser Abbildung leicht zu erkennen ist, lässt sich die Extrapolation für
starke Elektrolyte leicht durchführen. Für schwache Elektrolyte dagegen werden nur
ungenaue Werte erhalten, weil bei starken Verdünnungen
![]() stark konzentrationsanhängig ist.
Ob die nach der Extrapolation erhaltenen Werte als Stoffkonstanten gewertet werden
können, lässt nachprüfen:
stark konzentrationsanhängig ist.
Ob die nach der Extrapolation erhaltenen Werte als Stoffkonstanten gewertet werden
können, lässt nachprüfen:
Kohlrausch untersuchte Salzpaare mit einem gemeinsamen Ion auf ihre Leitfähigkeit und
rr machte die Beobachtung, dass hier die Differenz von
![]() 0
fast gleich groß ist:
0
fast gleich groß ist:
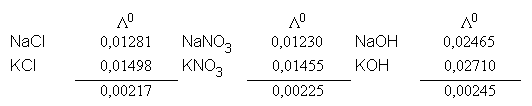 |
|
|
Nur bei unendlicher Verdünnung sind die elektrischen Beweglichkeiten der Ionen Stoffkonstanten und es gilt für die molare Grenzleitfähigkeit das Gesetz der unabhängigen Ionenwanderung!