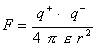 |
r
Abstand der Punktladungen voneinander
Dielektrizitätskonstante
Edelgase besitzen eine voll besetzte Valenzschale und sind daher sehr
reaktionsträge und stabil. Atome ohne volle Valenzschale sind bestrebt,
durch Elektronenaufnahme oder -abgabe, eine solche voll besetzte Schale zu erhalten.
Erreicht wird dies durch einen teilweisen Elektronenübergang von einem Atom auf ein
anderes, es findet eine Ladungsverschiebung statt. Dabei spielt die
Elektronegativität der einzelnen Atome
eine entscheidende Rolle: Die Aufenthaltswahrscheinlichkeit der
Bindungselektronen verschiebt sich zu dem Bindungsartner mit der höheren
Elektronegativität. Die Bindung wird polarisiert und erhält einen
heteropolaren bzw. ionischen Charakter. Es existiert kein gemeinsames
bindendes Elektronenpaar mehr, sondern nur noch positive und negative
Bausteine, die man als Ionen bezeichnet.
Die Ionenbindung ist charakteristisch für Salze, die entstehen, wenn
sich ausgeprägt elektropositive Elemente der 1. oder 2. Hauptgruppe mit
den elektronegativen Elementen der 7. Hauptgruppe verbinden. Aus diesem Grund bezeichnet
man die Elemente der 7. Hauptgruppe auch als Halogene (Salzbildner).
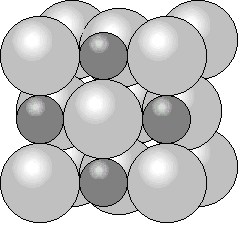
In Ionenkristallen werden die positiven und negativen Gitterbausteine durch relativ starke elektrostatische Kräfte zusammengehalten. Im Falle des Natriumchlorids wechseln sich positiv geladene Natrium- und negative geladene Chlorteilchen ab. Räumlich gesehen ist dabei jedes Natriumteilchen von sechs Chlorteilchen oktaedrisch umgeben und jedes Chlorteilchen von sechs Natriumteilchen (siehe Abbildung 2). Die Stärke der elektrostatischen Kräfte im Kristall lässt sich über das Coulomb'sche Gesetz bestimmen:
|
r |
Punktladungen Abstand der Punktladungen voneinander Dielektrizitätskonstante |
Die zwischen zwei Punktladungen q+ und q- herrschende Anziehungskraft F ist proportional dem Produkt der Ladungen und umgekehrt proportional dem Quadrat des Abstandes r.
Beim Natriumchlorid ist der Abstand der positiven und negativen Ladungen
klein, was zu einem hohen Wert für die Coulomb-Kraft führt. Dies
zeigt sich in den hohen Energiebeträgen, die zum Schmelzen eines Ionenkristalls
nötig sind. Beim Natriumchlorid sind es 801°C. Auch die Siedetemperaturen sind sehr hoch,
da hier die elektrostatischen Anziehungskräfte der Verdampfung entgegenwirken.
Die geometrische Struktur von Ionenkristallen ist so gewählt, dass die Anziehung
positiver und negativer Ionen untereinander die Abstoßung von Ionen gleicher
Ladung überwiegt.
 |
|
|
Abbildung 2:
Der NaCl-Ionenkristall. Die hellgrauen Kugeln stellen die Cl--Ionen dar, die kleinen dunklen die Na+-Ionen. |