Zentrales Nervensystem nach Verletzung heilbar?
Die Vielfalt und Präzision von neuronalen Verknüpfungen im Zentralen Nervensystem (ZNS) ermöglichen die außergewöhnlich komplexen kognitiven, sensorischen und motorischen Leistungen des Menschen und anderer Säugetiere. Eine Voraussetzung hierfür ist allerdings eine intakte Struktur und Funktion von zentralen Leitungsbahnen wie diese im Gehirn, Rückenmark oder Sehnerven verlaufen. Durch unfall- oder erkrankungsbedingte Schädigungen dieser Leitungsbahnen werden wesentliche Kommunikationsstrukturen unterbrochen, die hierdurch massive Funktionsverluste wie Lähmungen oder Erblindung zur Folge haben können. Da im Gegensatz zum Peripheren Nervensystem (PNS) durchtrennte Axone im ZNS nicht regenerationsfähig sind, sind derartige Funktionsverluste in der Regel irreversibel. Bis heute gibt es keine klinisch relevanten Therapieverfahren zur Heilung derartiger Schäden und damit verbundenen Behinderungen.
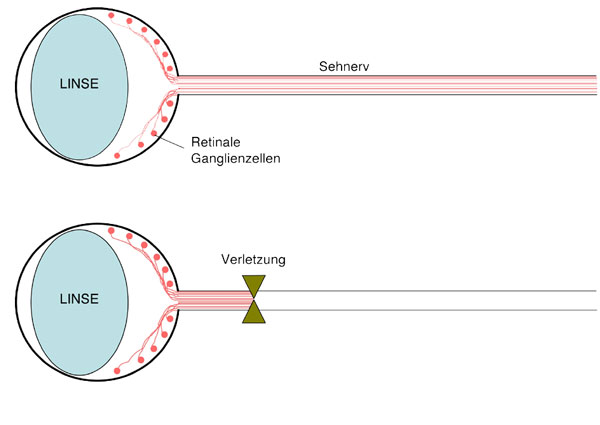
Retinale Ganglienzellen (RGZ) sind typische Projektionsneurone des ZNS und leiten die visuellen Signale von der Retina zum Gehirn. Nach Verletzungen des Sehnervens, bei denen die Axone der RGZ durchtrennt werden (Axotomie), können diese nicht mehr über die Verletzungsstelle hinaus regenerieren. Stattdessen beginnen sie innerhalb weniger Tage zu degenerieren. Die Folge ist ein irreversibler Verlust der Sehfähigkeit. Derartige Schädigungen treten neben traumatischen Verletzungen auch beim Glaukom, bei Tumoren und verschiedenen neurodegenerativen Erkrankungen auf. Die Ursachen für die schwache Regenerationsfähigkeit von zentralen Neuronen einschließlich RGZ liegen zum Teil an den destabilisierenden Eigenschaften des ZNS-Myelins und der sich an der Verletzungsstelle ausbildenden gliotischen Narbe auf dem Wachstumskegel, der vom Axon nach dessen Durchtrennung gebildet wird.
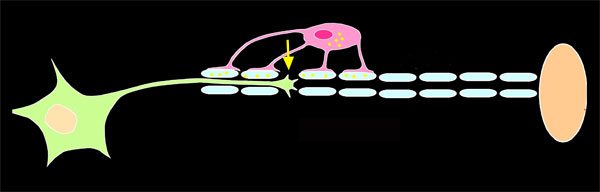
Darüber hinaus begründet sich die Regenerationsinsuffizienz vor allem durch die nur sehr schwach vorhandene intrinsische Fähigkeit zum Wachstum von Axonen. Während diese auch nach der Geburt im PNS erhalten bleibt, nimmt diese im ZNS dramatisch ab.
Vor einigen Jahren hat die Arbeitsgruppe von Prof. Dietmar Fischer entdeckt, dass eine Verletzung der Linse im Auge den axotomiebedingten Degenerationsprozess von RGZ stark verlangsamt und diese zudem in einen aktiven Regenerationszustand versetzt. In diesem Zustand bilden RGZ zahlreiche, für die axonale Regeneration wichtige Proteine und können Axone sogar in den distalen Teil des verletzten Sehnerven einwachsen. Derartige starke neuroprotektive und regenerationsfördernde Effekte konnten bislang durch kein anderes Verfahren erreicht werden, so dass die durch eine Linsenverletzung erzielte Regeneration in den Sehnerven einer der wenigen Beispiele für eine „erfolgreiche“ Regeneration im ZNS darstellt. Das Verständnis der molekularen Mechanismen, die diesem Phänomen zugrunde liegen, ist somit von großem wissenschaftlichen und klinischen Interesse, da auch andere Nervenzellen des ZNS hierdurch zur Stimulation der axonalen Regeneration angeregt werden könnten.
Es ist der Forschergruppe von Prof. Dr. Dietmar Fischer nun gelungen, einen entscheidenden Faktor zu bestimmen, durch den die Linsenverletzungseffekte mediiert und durch dessen Applikation in das Auge ähnliche Effekte wie bei einer Linsenverletzung erreicht werden können. Diese Daten sind vor kurzem in der renommierten Zeitschrift „Brain“ veröffentlicht worden.
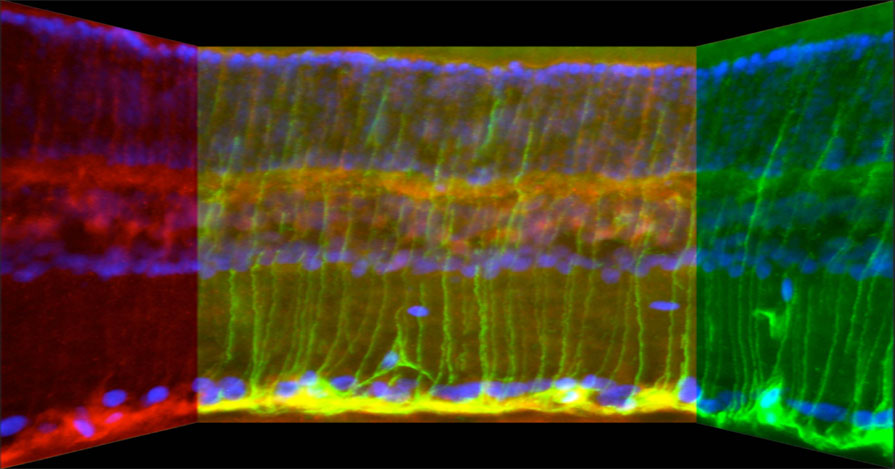
Hierbei handelt es sich um das Zytokin cililary neurotrophic factor (CNTF), dessen Expression in retinalen Gliazellen (Astrozyten, Müllerzellen) nach einer Linsenverletzung stark hochreguliert und anschließend über mehrere Wochen kontinuierlich freigesetzt wird. Dieses Zytokin interagiert dann direkt mit den RGZ und aktiviert dort bestimmte Signalwege, wodurch letztlich das Regenerationsprogramm der Nervenzellen aktiviert wird. Die Verwendung von Pharmaka, die diesen und weitere CNTF abhängige Signalwege aktivieren, stellen somit neue mögliche pharmakologische Therapeutika zur Neuroprotektion und Förderung der axonalen Regeneration von RGZ und gegebenenfalls anderen ZNS-Neuronen dar. Zur Aktivierung dieser Signalwege ist ebenso die Anwendung gentherapeutischer Methoden denkbar, bei der CNTF bzw. vergleichbare Faktoren in glialen Zellen über einen längeren Zeitraum exprimiert und kontinuierlich freigesetzt werden können.
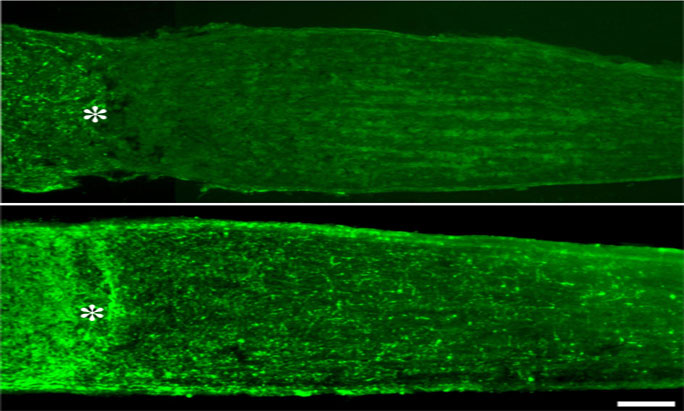
Verschiedene Ansätze, basierend auf den neu gewonnenen Erkenntnissen, werden gegenwärtig im Labor von Prof. Dr. Dietmar Fischer zur weiteren Optimierung der Neuroprotektion und Stimulation der axonale Regeneration von RGZ und anderen Neuronen im ZNS verfolgt. Die ersten Ergebnisse sind sehr ermutigend, und tragen hoffentlich zur Entwicklung neuer Strategien zur Reparatur des verletzten ZNS bei.
Prof. Dr. Dietmar Fischer ist Juniorprofessor in der Klinik für Neurologie, ärztlicher Direktor Prof. Dr. Albert C. Ludolph, und leitet dort den Arbeitskreis Neuronale Degeneration und Axonale Regeneration.
Seine Forschungsschwerpunkte sind:
- Molekularbiologische Grundlagen neuraler Degenerationsprozesse im Zentralen Nervensystem
- Molekularbiologische Grundlagen axonaler Regenerationsprozesse im Zentralen Nervensystem
- Entwicklung neuer gentherapeutischer und pharmakologischer Therapiekonzepte bei Verletzungen des Gehirns, des Rückenmarks und der Sehnerven sowie neurodegenerativer Erkrankungen
| Methoden und Techniken: | |
| - Molekularbiologie | - Histologie |
| - Biochemie | - Zellkultur |
| - Gewebekultur | - Tiermodelle |
| - Chirurgie |
Kontakt
- Prof. Dr. Dietmar Fischer
- Experimentelle Neurologie
- Albert-Einstein-Allee 11
- 89081 Ulm
- Telefon: +49 (0)731/500-63048
- Telefax: +49 (0)731/500-63049
Informationen
Neuronale Degeneration und Axonale Regeneration
Arbeitskreis, Prof. Dr. Dietmar Fischer
