
Substitutionstherapie mit Thrombozyten
Prof. Dr. med. B. Kubanek
Eine Abnahme der Thrombozyten im peripheren Blut unter Normwerte (150.000
- 400.000/µl) verändert die primäre Hämostase und
führt zu einer zunehmenden Verlängerung der Blutungszeit. Dank
der großen Reserven des menschlichen Gerinnungssystems ist selbst
bei einer Thrombozytenkonzentration von 30.000 - 50.000/µl noch mit
einer adäquaten Blutstillung bei invasiven Eingriffen zu rechnen.
Spontanblutungen treten bei einem sonst intakten Gerinnungssystem erst
bei einer Thrombozytenkonzentration < 5.000/µl vermehrt auf.
 Die
Thrombozytentransfusion zur Behandlung thrombozytopenischer Blutungen wurde
nach Einführung der Kunststoff-Mehrfachbeutel vor knapp 30 Jahren
zur Routinetherapie. Heute sind prophylaktische und therapeutische Thrombozytentransfusionen
ein unverzichtbarer Bestandteil einer intensiven zytostatischen Behandlung
sowie der Stammzelltransplantation bei malignen und nicht-malignen Erkrankungen.
Jedoch existieren wenig kontrollierte Studien über Dosierung oder
über den Vorzug bestimmter Präparate.
Die
Thrombozytentransfusion zur Behandlung thrombozytopenischer Blutungen wurde
nach Einführung der Kunststoff-Mehrfachbeutel vor knapp 30 Jahren
zur Routinetherapie. Heute sind prophylaktische und therapeutische Thrombozytentransfusionen
ein unverzichtbarer Bestandteil einer intensiven zytostatischen Behandlung
sowie der Stammzelltransplantation bei malignen und nicht-malignen Erkrankungen.
Jedoch existieren wenig kontrollierte Studien über Dosierung oder
über den Vorzug bestimmter Präparate.
Eine Thrombozytentransfusion ist immer indiziert, wenn der Patient durch
die Thrombozytopenie bedingt bedrohlich blutet (therapeutische Indikation).
Bei hyporegenerativen Thrombozytopenien (primäre oder sekundäre
Markaplasien durch Zytostatika) oder einer Dilutionsthrombozytopenie bei
Massivtransfusionen sind in bestimmten Situationen auch ohne aktuelle Blutungen
prophylaktische Thrombozytengaben bei Absinken der Thrombozyten unter bestimmte
Grenzwerte sinnvoll.
Hier soll eine Transfusionsstrategie zur prophylaktischen Thrombozytentransfusion
vorgestellt werden, die in den letzten 25 Jahren am Universitätsklinikum
Ulm unter Einbeziehung der eigenen Erfahrungen, der relevanten Literatur
sowie verbesserter Thrombozytenpräparate praktiziert wird.
Präparate
Die Thrombozytenpräparate sind vom Paul-Ehrlich-Institut, Langen
zugelassene Arzneimittel und unterliegen einer Herstellungsgenehmigung
nach dem Arzneimittelgesetz. Thrombozytenpräparate werden entweder
aus frisch abgenommenen Vollbluteinheiten oder durch maschinelle Thrombozytapherese
von einem einzelnen Blutspender gewonnen. Als optimales Thrombozytenpräparat
gilt heute das leukozytendepletierte Thrombozytenpräparat. Durch die
Leukozytenreduktion wird ein Großteil der Nebenwirkungen, nämlich
die Häufigkeit der Alloimmunisierung
und der febrilen Transfusionsreaktionen,
reduziert.
Thrombozytenpräparat, leukozytenarm (Standard)
Aus vier gepoolten Buffycoats (BC) von frisch abgenommenen Vollblutspenden
wird innerhalb von 24 Stunden eine Thrombozytensuspension, in additiver
Lösung als partieller Plasmaersatz, hergestellt. Über einen Filter
werden mehr als 99% der Restleukozyten entfernt. Die Vollblutspenden stammen
ausschließlich von Mehrfachspendern, die auf Infektionsmarker mehrfach
untersucht sind. Der Thrombozytengehalt dieser Präparate beträgt
durchschnittlich 3,5 x 10^11 und ist ausreichend für die Substitution
eines normalgewichtigen Erwachsenen (siehe Tabelle
1). Die Präparate können fünf Tage gelagert werden und
werden auf Vorrat hergestellt. Sie sind als Standardpräparat sofort
verfügbar.
Tabelle 1 (vergrößerte
Ansicht):
Verfügbare Thrombozytenpräparate
beim DRK-Blutspendedienstes Baden-Württemberg (Stand
1. Januar 1999)
|
|
Präparate
|
Volumen
|
Thrombozytengehalt
|
Leukozytengehalt
|
Erythrozytengehalt
|
Spender/Präparat
|
Indikationen
|
|
|
260 ml
|
3,5 x 10^11
(1,8 - 5,4)
|
< 0,3 x 10^6
|
< 0,04 x 10^8
|
4
|
Standard (therapeutisch, prophylaktisch)
|
|
|
262 ml
|
4,4 x 10^11
(2,1 - 6,5)
|
< 0,1 x 10^6
|
< 0,04 x 10^8
|
1
|
HLA-kompatibel
(Patienten nach Immunisierung)
|
Variation bedingt durch den weiten Bereich der Normwerte
150.000 bis 400.000/µl |
Thrombozytapherese-Präparat
Es wird mit Zellseparatoren von Einzelspendern gewonnen. Innerhalb von
etwa 60 bis 90 Minuten wird ein Konzentrat mit ca. 4 x 10^11 Thrombozyten
hergestellt. Die modernen Apheresetechniken beinhalten eine Methode zur
Leukozytenreduktion, so daß auch bei diesem Präparat der Leukozytengehalt
auf < 1 x 10^5 reduziert wird (siehe Tabelle
1). Die Spender stammen aus einem HLA-getesteten Mehrfachspenderstamm,
der regelmäßig Blut spendet und daher häufig auf Infektionsmarker
etc. untersucht wird. Da die Spender einbestellt werden müssen, ist
eine Vorlaufzeit für dieses Präparat von 24 Stunden notwendig.
Der Blutspender kann HLA-kompatibel zum Empfänger ausgewählt
werden. Das Thrombozytapharese-Präparat ist bei Patienten nach HLA-Immunisierung,
die refraktär auf Standard-Thrombozytenpräparate
sind, das Präparat der ersten Wahl.
Andere Thrombozytenpräparate
Diese beiden leukozytendepletierten Thrombozytenpräparate entsprechen
dem heutigen Stand der Wissenschaft. Sie sind ausreichend für eine
moderne, kosteneffiziente Transfusionsstrategie. Die bislang eingesetzten
Präparate wie Einzel-Thrombozytenkonzentrat etc. sind damit nicht
mehr notwendig. Es existieren keine überzeugenden Daten, die einen
Unterschied in der Wirksamkeit, der Lagerungsfähigkeit etc. belegen
zwischen Thrombozytenpräparaten, gewonnen aus Vollblutspenden oder
mittels Thrombozytapherese. Vorteil der Thrombozytapherese gegenüber
Thrombozyten aus Vollblut ist die geringere Anzahl notwendiger Spender,
Nachteile sind der wesentlich höhere Preis und das höhere Spenderrisiko.
Die Exposition gegenüber einer höheren Spenderzahl durch Vollblut-Thrombozytenkonzentrate
im Vergleich zu Apherese-Thrombozytenkonzentraten spielt für die Alloimmunisierung
keine Rolle wie klinische Studien belegen (TRAP-Studie).
Das immer wieder angeführte nummerisch höhere Infektionsrisiko
ist bei der Inzidenz von HIV, HCV und HBV in der baden-württembergischen
Spenderpopulation bei zusätzlicher PCR-Testung unseres Erachtens unter
klinischen Aspekten nicht entscheidend (siehe Tabelle
2).
Tabelle 2 (vergrößerte
Ansicht):
Aktuelle Infektionsgefahr durch Blutpräparate
von Einzelblutspenden
beim DRK-Blutspendedienstes Baden-Württemberg
|
|
Virus
|
bei Mehrfach-Blutspendern
|
Gesamte Blutspenderpopulation
|
|
HCV
|
1:300.000 |
1:270.000 |
|
HBV
|
1:600.000 |
1:500.000 |
|
HIV
|
1:2.500.000 |
1:2.000.000 |
rechnerische Infektionsrate nach Kleinman et al. Transfus
Med Rev 11(1997)155-172
und Koerner et al. Vox
Sang 74(1998)213-216 im Erhebungszeitraum 1995 bis 1998 |
Auswahl der Präparate
Die wichtigsten Antigensysteme auf den Thrombozyten sind die HLA-Antigene,
die plättchenspezifischen Antigene und die auf Plättchen wenig
ausgeprägten AB0-Blutgruppenantigene. Solange Patienten nicht durch
vorangegangene Schwangerschaften oder Bluttransfusionen Alloantikörper
gebildet haben, die zur Refraktärität gegen Thrombozytentransfusionen
führen, genügt es, leukozytendepletierte Thrombozytenkonzentrate
von unausgewählten Vollbutspendern zu transfundieren, die kompativel
für AB0- und insbesondere für Antigen D sind. Damit können
80% aller Patienten mit einer hyporegenerativen Thrombozytopenie auch langfristig
versorgt werden, ohne daß sie refraktär werden.
15 - 20% der Patienten, die durch Schwangerschaft oder Vortransfusion
mit Fremdantigenen auf Leukozyten in Kontakt waren, sind immunisiert und
können selbst durch leukozytendepletierte Präparate weiter immunisiert
werden. Nach eingetretener Alloimmunisierung gegen HLA und/oder plättchenspezifische
Antigene müssen die Patienten von den Standard-Thrombozytenpräparaten
auf Thrombozytapharese-Präparate von
ausgewählten Einzelspendern umgestellt werden, deren Antigenmuster
kompatibel ist.
Dosierung der Präparate
Die zu transfundierende Thrombozytenzahl läßt sich unter
Berücksichtigung von gewünschtem Inkrement, Milz-Pool (30 %)
und Blutvolumen wie folgt berechnen:
Thrombozytendosis = Inkrement (x 10^9/l) x
Blutvolumen (l) x
1,5
Für eine Dosis von ca. 3 x 10^11 Thrombozyten, die zu einem Anstieg
von etwa 40 x 10^9/l bei normalgewichtigen Erwachsenen führt, sind
demnach ein Standard-Thrombozytenpräparaten
(entsprechend vier Thrombozytenkonzentraten von Einzelspendern wie sie
bis 1998 angewendet wurden) oder ein Thrombozytapharese-Präparat
erforderlich.
Lagerung
Thrombozytenpräparate mit additiver Lösung (T-SOL) oder mit
Plasma bis zu fünf Tagen bei 22 ± 2°C unter gleichmäßiger
Agitation gelagert werden. Sie sollten nach Auslieferung sofort transfundiert
werden. Eine Lagerung - auch Zwischenlagerung - bei niedrigeren Temperaturen
ist strikt zu vermeiden.
Indikationen
Hauptindikation der prophylaktischen und therapeutischen Thrombozytensubstitution
ist die hyporegeneratorische Thrombozytopenie. In mehreren Studien wurde
dadurch die Blutungsmortalität um 40 - 50% gesenkt. Relevante Blutungen
treten in der Regel erst bei Thrombozytenkonzentrationen von kleiner 10
x 10^9/l auf. Die multifaktorielle Genese von Blutungen, wie z. B. bei
der akuten Leukämie, ist für die Therapieentscheidung stets zu
berücksichtigen (siehe Abbildung).
Neben einer Thrombozytopenie können auch Thrombozytenfunktionsstörungen
zur hämorrhagischen Diathese führen.
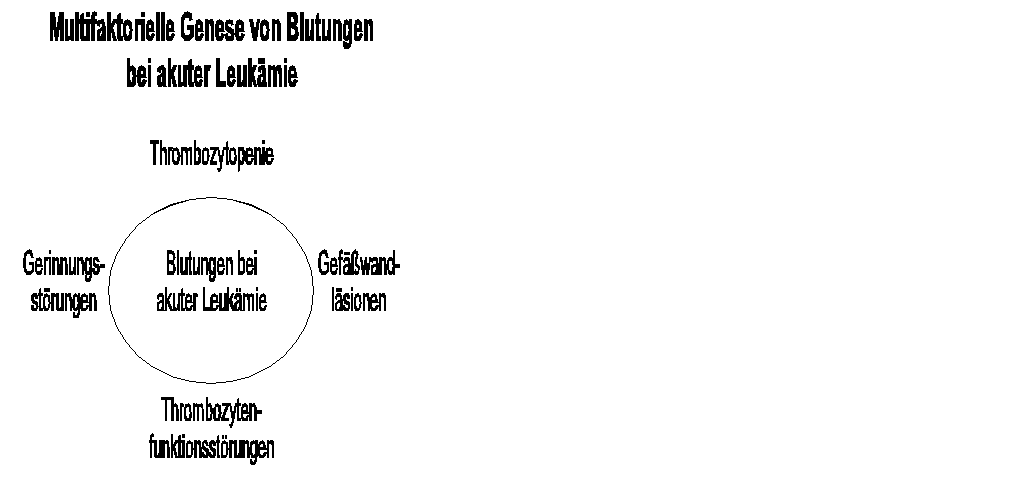
Folglich ist eine klinisch manifeste Blutungsneigung, die durch die
"in vivo" Blutungszeit gemessen werden kann, gravierender einzustufen als
die Thrombozytenkonzentration. Da es sich jedoch häufig um neutropenische
Patienten handelt und die Messung der Blutungszeit ein zusätzliches
Infektionsrisiko darstellt, werden in der täglichen klinischen Routine
folgende Schwellenwerte für die Indikation einer Thrombozytensubstitution
vorgeschlagen:
Thrombozyten < 10 x 10^9/l
- keine Blutungszeichen
- keine zusätzlichen Blutungsrisiken (z. B. Infektion, Gerinnungsstörung)
- keine Alloimmunisierung
- engmaschige klinische Überwachung
Thrombozyten < 20 x 10^9/l
- Blutungszeichen (z. B. Petechien) ohne vitale Bedrohung
- zusätzliche Blutungsrisiken (s. o., ZNS-Befall, Antikoagulanzien)
- Alloimmunisierung (Verfügbarkeit HLA-typisierter Thrombozytenkonzentrate)
- regelmäßiges Monitoring nicht möglich
Thrombozyten < 50 x 10^9/l
- invasive Eingriffe (cave: bei Gehirn- und Augen-OP höherer Schwellenwert)
- Stammzellapherese
- Massivtransfusion (Ersatz von mehr als dem 1,5 bis 2fachen Körperblutvolumen)
Thrombozyten < 80 x 10^9/l
- invasive Eingriffe am Gehirn und Auge
Alloimmun-Thrombozytopenie bei Neugeborenen
Eine seltene Indikation zur Thrombozytensubstitution ist die Alloimmun-Thrombozytopenie
des Neugeborenen. Mütterliche IgG-Antikörper überschreiten
die Plazentaschranke und reagieren mit Antigenen des HPA-Systems (in der
Regel HPA-Ia) auf den kindlichen Thrombozyten. Die resultierende hämorrhagische
Diathese führt in einem Viertel dieser Neugeborenen zum Tod oder zu
neurologischen Ausfallserscheinungen. Mangels geeigneter Vorsorge-Untersuchungen
ist eine Diagnose derzeit nur bei der Manifestation möglich. Neugeborene
mit neonataler Alloimmun-Neutropenie können mit Thrombozytapharese-Präparaten
von Spendern, die dieses Antigen nicht tragen, oder mit Thrombozyten der
Mutter substituiert werden (gerichtete Blutspende - cave: Bestrahlungsindikation!).
Autoimmun-Thrombozytopenie
Bei Autoimmun-Thrombozytopenie hingegen kann eine Thrombozytentransfusion
lediglich bei schweren Blutungskomplikationen indiziert sein, da auch bei
allogenen Thrombozytentransfusionen wegen der verkürzten Lebenszeit
nur ein kurzfristiger Transfusionseffekt zu erwarten ist.
Angeborene Thrombozytopathien
Bei angeborenen Thrombozytopathien (z. B. Bernard-Soulier-Syndrom, "Storage-Pool-Disease"
oder Gray-Platelet-Syndrom) ist gelegentlich eine Thrombozytentransfusion
bei Blutungen oder vor operativen Eingriffen erforderlich.
Kontraindikationen
Eine Thrombozytentransfusion kann zu pathophysiologische Vorgängen
beitragen, die zu einer thrombophilen Diathese z. B. im Rahmen der disseminierten
intravasalen Gerinnung (DIC) führen. Weitere Kontraindikationen sind
thrombotisch-thrombozytopenischer Purpura (TTP) und Heparin-induzierter
Thrombozytopenie (HIT). Bei Verdacht auf diese Erkrankungen sollte nur
bei strengster Indikationsstellung und unter entsprechenden Kontrollen
Thrombozyten substituiert werden.
Nebenwirkungen
Die meisten akuten Transfusionsreaktionen werden entsprechend ihrer
Pathophysiologie durch die Leukozytendepletion und Plasmareduktion verhindert.
Febrile Reaktionen
Febrile Reaktionen sind meist bedingt durch eine immunologische Reaktion
von Antikörpern des Empfängers gegen Antigene auf den transfundierten
Spenderleukozyten. Diese Art der Reaktion sind nur mehr selten zu erwarten
und kommen in der Regel nur bei Polytransfundierten oder Schwangeren vor.
Febrile Reaktionen auf pyrogene Zytokine, die aus Leukozyten freigesetzt
werden, werden durch die frühzeitige Leukozytendepletion vermieden.
Thrombozyten-Präparate wie sie seit Jahren in Deutschland verwendet
werden, waren auch ohne Leukozytendepletion durch Filtration weitgehend
frei von Zytokinen wie Studien zur Qualitätskontrolle zeigten (Thrombozyten-Studie).
Das seltene Risiko einer Posttransfusionspurpura, bedingt durch Antikörper
des Empfängers gegen thrombozytenspezifische Antigene auf Spenderthrombozyten,
bleibt bestehen.
Bakterielle Kontamination
Die bakterielle Kontamination wird durch die für Thrombozyten notwendige
Lagerungstemperatur (von 22 ± 2°C) begünstigt. Das Kontaminationsrisiko
liegt bei 0,04% - 0,1% aller Präparate. Bei Auftreten von septischen
Temperaturen nach einer Transfusion sollten sowohl aus dem Empfänger
als auch aus dem transfundierten Präparat Proben für bakterielle
Kulturen entnommen werden.
Virale Kontamination
Die virale Kontamination von Blutprodukten ist durch eine konsequente
Spenderauswahl und Spenderuntersuchung unter den Blutspendern in Baden-Württemberg
sehr gering (siehe Tabelle
2). Zusätzlich wird durch eine Untersuchung jeder Blutspende mittels
der PCR-Technik das Risiko für die in der Tabelle 2 aufgeführten
Infektionen weiter vermindert.
Das Risiko einer CMV-Infektion wird durch die Leukozytendepletion fast
vollständig eliminiert wie klinische Studien zeigten (CMV-Studie).
Nur für besondere Risikopatienten, wie z. B. nach einer allogenen
Stammzelltransplantation oder bei Kleinkindern mit einem schweren kombinierten
Immundefekt (SCID-Syndrom), empfehlen wir nur Präparate anzuwenden,
die von anti-CMV-Antikörper-negativen Blutspendern stammen.
DRK-Blutspendedienst Baden-Württemberg
Stand Februar 1999
 Die
Thrombozytentransfusion zur Behandlung thrombozytopenischer Blutungen wurde
nach Einführung der Kunststoff-Mehrfachbeutel vor knapp 30 Jahren
zur Routinetherapie. Heute sind prophylaktische und therapeutische Thrombozytentransfusionen
ein unverzichtbarer Bestandteil einer intensiven zytostatischen Behandlung
sowie der Stammzelltransplantation bei malignen und nicht-malignen Erkrankungen.
Jedoch existieren wenig kontrollierte Studien über Dosierung oder
über den Vorzug bestimmter Präparate.
Die
Thrombozytentransfusion zur Behandlung thrombozytopenischer Blutungen wurde
nach Einführung der Kunststoff-Mehrfachbeutel vor knapp 30 Jahren
zur Routinetherapie. Heute sind prophylaktische und therapeutische Thrombozytentransfusionen
ein unverzichtbarer Bestandteil einer intensiven zytostatischen Behandlung
sowie der Stammzelltransplantation bei malignen und nicht-malignen Erkrankungen.
Jedoch existieren wenig kontrollierte Studien über Dosierung oder
über den Vorzug bestimmter Präparate.

